مهندسی خوردگی چیست؟
در این مقاله از مجله تخصصی خوردگی، به اینکه خوردگی چیست و مباحث مرتبط با آن میپردازیم.
خوردگی یک پدیده طبیعی است که در پی رسیدن مواد به کمترین سطح انرژی آزادشان رخ میدهد. این پدیده موجب انهدام و از بین رفتن ماده، در اثر واکنش با محیطی که با آن در تماس است، میشود.
براساس باور برخی صاحب نظران، این تعریف باید محدود به فلزات شود. ولی اغلب مهندسین خوردگی باید هم برای فلزات و هم غیر فلزات در برابر این پدیده چاره اندیشی کنند.
بنابراین نباید این پدیده را مختص به فلزات دانست. خوردگی همراه با از دست دادن براقیت، شکل ظاهری، وزن و در بسیاری از موارد کارایی قطعه در سرویس است. هر چند، تمام مواد دچار این پدیده نخواهند شد. درصد وقوع آن متناسب با رفتار ماده و شرایط محیطی است که با آن در تماس هستند.
در ادامه، مطلب جامعی در خصوص اینکه خوردگی چیست مورد بحث قرار می گیرد.
مهندسی خوردگی، تلفیق کاربردی علم و هنر در راستای پیشگیری و کنترل تخریب از لحاظ اقتصادی و ایمنی است.
بنابراین، به منظور داشتن عملکرد مناسب، مهندسین خوردگی باید مهارتهای کافی در زمینههای زیر بدست آورده باشند.
- اقدامات و اصول خوردگی
- خواص شیمیایی، مکانیکی فیزیکی و مکانیکی مواد
- آزمونهای خوردگی
- طبیعت محیط خورنده
- در دسترس بودن مواد
- تجهیزات الکترونیکی و طراحی
خوردگی چیست؛ رفتار مواد در محیط

برای اینکه درباره خوردگی بهتر بدانیم ، باید رفتار مواد را در واکنش به محیطی که در آن قرار دارند، بدانیم. در این خصوص میتوانیم رفتار مواد را در سه گروه مورد بررسی قرار دهیم:
گروه اول
ایمن بودن، اولین رفتاری است که برای مواد میتوان متصور شد. به عنوان مثال بارها و بارها میتوان پلاتین را در محلولهای اسیدی قرارداده و بازهم از آن بهره جست. شیشه و پلاستیک نیز تا حدی رفتار مشابه نشان میدهند و نسبت به برخی از اسیدهای خورنده مقاوم هستند.
این همان چیزی است که به عنوان رفتار ایمن یا نجیب شناخته میشود. گروه بزرگی از فلزات مانند طلا، نقره و پلاتین در این دسته قرار میگیرند. هرچند، مواد نجیب متناسب با محیطی که در تماس با آن هستند میتوانند رفتار متفاوتی از خود نشان دهند.
گروه دوم
شاید پردردسرترین گروه که به علت کاهش چشمگیر هزینهها همیشه به کمک صنعت شتافته است. این گروه، شامل فلزات فعال است.
حضور این گروه در محیطهای خورنده، با از دست دادن براقیت، زیبایی ظاهری، کاهش وزن و ایجاد سطوح ناهموار و متخلخل همراه است. خوردگی نردههای فلزی، درها و پنجرههای آهنی علی الخصوص آنهایی که در مناطق مرطوب جنوبی و شمالی کشور نصب شدهاند. اینها از ملموسترین مثالهای پدیده خوردگی در اطرافمان هستند.
آهن و فولاد به عنوان پرکاربردترین مواد اولیه در صنعت در این دسته جای دارند. روی، سدیم و منیزیم هم رفتار مشابهی دارند. به همین دلیل است که سدیم را فقط میتوان زیر نفت و روغن نگه داری نمود.
آهن و فولاد در رنج وسیعی از محیطهای آبی و گازی خورده میشوند. معمولترین خوردگی آهن و فولاد در محیطهای آبی و در محیط مرطوب رخ میدهد.
گروه سوم
مرموزترین گروه فلزاتی هستند که میتوانند از حالت فعال به غیرفعال یا پاسیو تغییر وضعیت دهند.
شناخته شدهترین ماده در این گروه آلومینیوم است. آلومینیوم پس از آهن به دلیل ویژگیهای منحصر به فردش، پرکاربردترین فلز در صنعت است. از جمله ویژگی های آن، تشکیل لایه مقاوم و نازک اکسید آلومینیوم (Al2O3) است. این باعث میشود، آن را در برابر خوردگی محافظت کند.
پایداری لایه پاسیو میتواند دستخوش عوامل محیطی شود. مثلا، تغییرات پیش بینی نشده در غلظت یونهای خورنده که تمام محاسبات مهندسی را تحت الشعاع قرار میدهد.
خوردگی چیست؛ انواع خوردگی چیست ؟
طبقه بندی اشکال خوردگی سالهاست که با دیدگاههای متفاوتی انجام شده است.
یک دیدگاه گسترده خوردگی را به دو دسته تقسیم میکند:
خوردگی که تحت تأثیر هیچ فرایند دیگری قرار نمیگیرد و خوردگی که تحت تأثیر فرآیند دیگری قرار میگیرد، مانند وجود تنش یا فرسایش.
یک دیدگاه متمرکزتر خوردگی را به صورت یکنواخت یا موضعی، آبی یا گازی، مرطوب یا خشک و غیره طبقه بندی میکند.
پدیده خوردگی به شکلهای متفاوتی در تجهیزات ظهور میکند. گاه شکل ظاهری قطعه دست نخورده باقی مانده و تنها نقاط خاصی دچار ترک و سوراخ شدگی میشود. آشنایی با انواع خوردگی میتواند در شناسایی صحیح این پدیده و یافتن راههای مقابله با آن مفید باشد.
در ادامه با انواع خوردگی بیشتر آشنا میشویم.
خوردگی یکنواخت (Uniform Corrosion)
شایعترین، معروفترین و شناخته شدهترین نوع خوردگی، خوردگی یکنواخت (Uniform Corrosion) است. فرآیندهای خوردگی یکنواخت شامل بسیاری از پدیدههای خوردگی است که در عمل مهندسی خوردگی و علم خوردگی با آن روبرو میشوند. اکثر این پدیدهها با خوردگی آبی یا گازی سروکار دارند.
این پدیده با یک واکنش شیمیایی یا الکتروشیمیایی شناسایی میشود. این واکنش، به شکل یکنواخت در سرتاسر قطعه یا یک سطح بزرگ پیشروی میکند.
در اثر این پدیده، فلز نازک شده و نهایتا تخریب میشود.
به عنوان مثال، یک قطعه از آهن یا روی با سرعت یکنواختی در کل سطحش در اسید سولفوریک رقیق حل میشود. گرچه از لحاظ فنی این نوع خوردگی باعث ایجاد نگرانی بزرگی نمیشود، زیرا عمر قطعه را میتوان توسط آزمونهای خوردگی به گونهای دقیق تخمین زد. واکنشی شیمیایی که برای اتمهای فلز خورده شده رخ میدهد به صورت زیر است:
Fe → Fe+2 + 2e–
به عبارت دیگر در طی واکنشهای خوردگی اتمهای فلزی به یونهای فلزی تبدیل شده و وارد محلول میشوند. شکل زیر خوردگی یکنواخت یک میخ فولادی را نشان میدهد.
از خوردگی یکنواخت میتوان توسط روشهای خاصی جلوگیری کرد یا سرعتش را کاهش داد. این روشها شامل استفاده از متریال یا مواد مناسب مانند پوششها، بازدارندهها و حفاظتکاتدی است.
مطلب مرتبط: حفاظت کاتدی

خوردگی گالوانیک (Galvanic Corrosion)
نوع شایع دیگر، خوردگی گالوانیک یا دوفلزی است. این نوع از خوردگی در اثر اختلاف پتانسیل بین دو فلز ناهمجنس رخ میدهد؛ زمانی که در یک محیط خورنده یا محلول رسانا قرار دارند.
اختلاف پتانسیل حتی روی سطح یک قطعه یا فلز نیز وجود دارد. علت آن حضور مرزدانهها با جهت گیریهای متفاوت، ناخالصیها و عیوب است. این اختلاف پتانسیل معمولا کوچک است و نمیتواند باعث خوردگی شدیدی شود. ولی فلز نامتجانس عموما اختلاف پتانسیل بیشتری اعمال میکند. این اختلاف پتانسیل باعث جریان یافتن الکترونها میشود.
در این حالت، فلزی که از نظر الکتروشیمیایی فعالتر است، دچار انحلال و از دست دادن اتمهایش میکند.
در پی خوردگی گالوانیک، خوردگی فلز مقاومتر کمتر شده و خوردگی فلز کمتر-مقاوم در مقایسه با زمانی که دو فلز در اتصال با یکدیگر قرار ندارند بیشتر میشود. فلز کمتر- مقاوم آند و فلز مقاوم تر نقش کاتد را بازی می کند.
ویدئو زیر را در ارتباط با خوردگی گالوانیک و اینکه خوردگی چیست مشاهده بفرمایید.
اصطلاح خوردگی دو فلز
از آنجا که جریان الکتریکی و دوفلز ناهمجنس یا غیر متشابه درگیر هستند، این خوردگی گالوانیک (برقی) یا دو فلزی نامیده میشود. نیروی محرکه جریان و خوردگی اختلاف پتانسیل بین دوفلز است. آنچه به عنوان پیل خشک شناخته میشود مثال خوبی از پدیده مذکور است.
الکترودکربنی به عنوان یک فلز نجیب یا مقاوم به خوردگی و روی به عنوان آند عمل میکند و خورده میشود. خمیر مرطوب بین الکترودها محیط رسانایی است که حامل جریان است. منیزیم نیز به عنوان آند استفاده میشود.
برای بررسی واضح تر خوردگی گالولانیک و شناخت اینکه خوردگی چیست به تصویر زیر توجه کنید.


EMF و سری گالوانیک در خوردگی چیست؟
اختلاف پتانسیل بین فلزات تحت شرایط برگشت پذیر یا غیر خورنده اساس پیش بینی تمایل به خوردگی را شکل میدهد. پتانسیل بین فلزاتی که در معرض محلولهایی که شامل یک گرم اتمی از یون هایشان هستند در یک ثابت اندازه گیری میشود. شکل زیر چنین جدولی را نشان میدهد که به جدول نیروی الکتروموتوری یا emf معروف است.

به جهت سادهسازی تمامی پتانسیلها نسبت به +H2/H که صفر در نظر گرفته میشود سنجیده شدهاند. پتانسیل بین فلزات با درنظر گرفتن اختلاف مطلق بین پتانسیل emf شان تعیین شده است. به عنوان مثال پتانسیل 0.462 ولت بین الکترودهای برگشت پذیر مس و نقره و 1.1 ولت بین الکترودهای برگشت پذیر مس و روی برقرار است.
در دنیای واقعی، زوجهای گالوانیکی به ندرت در محیط حاوی یونهایشان قرار دارند. اما از آنجا که بیشتر مواد مهندسی آلیاژ هستند، زوجهای گالوانیکی شامل یک (یا دو) آلیاژ فلزی میشوند. تحت این شرایط سری گالوانیک زیر میتواند برای پیش بینی ارتباطهای گالوانیکی موثر باشد.

اثرات محیطی بر خوردگی گالوانیکی
طبیعت و خوردگی محیط میزان خوردگی دوفلزی را تا حد زیادی میتواند مشخص کند. معمولا فلز با مقاومت کمتر نسبت به محیط خورندهاند و فلز با مقاومت بیشتر کاتد میشود. گاهی اوقات، پتانسیل برای زوج فلزی برعکس میشود. جدول زیر رفتار متفاوت روی و فولاد را در محیطهای مختلف نمایش میدهد.
اثر دما بر خوردگی گالوانیکی
معمولا روی و فولاد هر دو در محیط خورده میشوند. ولی وقتی که در کنار یکدیگر قرار میگیرند یا زوج میشوند، روی خورده شده و فولاد محافظت میشود. در موردی استثنایی مثل آبهای خانگی در دماهای بیش از ◦180 فارنهایت، این زوج برعکس میشود و فولاد آند میشود.
محصولات خوردگی فلز روی باعث میشوند که مانند یک فلز نجیبتر از فولاد عمل کند. همچنین Haney نشان داده است که روی در حضور یونهای بازدارنده مانند نیتراتها، بی کربناتها، و کربناتها در آب کمتر فعال میشود.
تانتالوم نیز یک فلز مقاوم به خوردگی است که نسبت به پلاتین و کربن آند است. اما این سل در دماهای بالا فعال است. به عنوان مثال، برای زوج تانتالوم-پلاتین تا دما به ◦ 110 سانتی گراد نرسد جریان برقرار نمیشود و جریان 100mA/ft در◦265 سانتی گراد جاری میشود.
تانتالوم نسبت به آهن با درصد سیلیکون بالا در اسید سولفوریک قوی کاتد است، اما جریان به سرعت به صفر میرسد. زیرا، در دمای ◦145 سانتی گراد پلاریتی (قطبیت) سل برعکس میشود. تانتالوم نباید در تماس با فلزات آندی باشد، چرا که هیدروژن کاتدی را جذب میکند و ترد میشود.
اثر اتمسفر بر خوردگی گالوانیکی
خوردگی گالوانیکی در اتمسفر هم رخ میدهد. شدت خوردگی بسیار به نوع و میزان رطوبت دارد. برای مثال، خوردگی در نزدیکی ساحل بیشتر از اتمسفر خشک است. میعانات بوجود آمده در محیط ساحل دارای نمک بیشتری هستند و جریان الکتریکی را به راحتی هدایت میکنند و الکترولیت بهتری است نسبت به آنچه که در محیطهای خشک پدید میآید.
آزمونهای اتمسفری نشان داده است که روی نسبت به فولاد آند است، اما قلع و نیکل همیشه کاتد هستند و آلومینیوم رفتاری متفاوت دارد. زمانی که فلزات در محل خشک قرار دارند خوردگی گالوانیک رخ نمیدهد، زیرا الکترولیتی برای حمل بار بین دو الکترود وجود ندارد. در آبهای با مقاومت بالا یا کاملا خالص، حمله خوردگی میتواند یک شیار عمیق باشد. خوردگی دوفلزی با حملات موضعی نزدیک اتصالات رخ میدهد.
اثر فاصله بر خوردگی گالوانیکی
حملات خوردگی به سبب خوردگی دوفلزی (گالوانیک) در نزدیکی اتصالات بیشتر است و با دور شدن از آنها کمتر رخ میدهد. اثر فاصله به هدایت محلول بستگی دارد. زمانی که مسیر طولانیتر است بالطبع، مقاومت بیشتری برای انتقال بار وجود دارد.
اثر سطح بر خوردگی گالوانیکی
فاکتور مهم دیگر در خوردگی گالوانیکی اثر سطح است، یا نسبت سطح کاتدی به آندی. سطحی که برای ما دردسر ساز است سطحی است با نسبت زیاد کاتد به آند. برای یک جریان مشخص در سل، دانسیته جریان برای یک الکترود کوچکتر، در ناحیه آندی بزرگ تر است. هرچه دانسیته جریان آندی بزرگتر باشد، نرخ خوردگی بیشتر است. خوردگی ناحیه آندی ممکن است 100 تا 1000 برابر بیشتر از زمانی باشد که آند و کاتد از لحاظ سطح برابر هستند.
سری گالوانیک اشاره میکند که آهن نسبت به مس آند است و بنابراین زمانی که با آن در تماس است سریعتر خورده میشود. این اثر زمانی که سطح کاتد از سطح آند خیلی بزرگتر است تشدید میشود. شکلهای زیر نتایج حاصل از نگهداری میخ پرچ فولادی در تماس با یک قطعه مسی در محلول کلریدسدیم 3درصد را در زمانهای مختلف نشان میدهد.



همانگونه که مشاهده میشود با گذشت زمان میخ های فولادی به شدت خورده میشود. گرچه، در شرایط معکوس زمانی که سطح آهن بسیار بزرگتر از مس است، خوردگی آهن فقط کمی تشدید میشود.



خوردگی موضعی
بنابراین انتشارحفرهها بر روی سطوح فلزی پاسیو، حملات شدیدی که در شیارهای پیش آمده از همپوشانی دوفلز ایجاد میشود. همچنین تخریبی که در آن دو فلز با یکدیگر واکنش میدهند و شکاف ایجاد میکنند، و تخریب رشته مانند (filiform) سطوح فلزی که با لایههای نازک آلی پوشانده شده است، ناشی از تفاوت در متالورژی آلیاژها و به دلیل شیمی موضعی متفاوت محیط است.
یک خوردگی موضعی شدید که معمولا بین شیارها و یا دیگر سطوح پوشش داده شده فلز، که در معرض خورندهها هستند ایجاد میشود، خوردگی شیاری نامیده میشود.
این مدل خوردگی عموما با حجمهای کوچکی از محلول ساکن مرتبط است؛ که به واسطه حضور سوراخها، واشرها، سطوح همپوشانی شده، رسوب سطوح، شیارهای زیر پیچ و سر میخ پرچها ایجاد میشود.
نام دیگر این پدیده، خوردگی واشری یا رسوبی است.
مکانیزم خوردگی شیاری
تا کنون، اینگونه تصور میشد که خوردگی شیاری از تفاوت در یونها یا غلظت اکسیژن بین شیار و محیط اطرافش پدید میآید. متعاقبا واژه پیل غلظتی نیز برای این نوع خوردگی استفاده میشد. اخیرا اثبات شده که گرچه تفاوت غلظت یونها و اکسیژن در خوردگی شیاری وجود دارد، عامل پایهای نخواهد بود.
برای آشکار شدن مکانیزم خوردگی، صفحه پرچ شده فلز M را در نظر بگیرید که در محلول آب دریای هوادهی شده (pH7) غوطه ور شده است. واکنش نهایی شامل انحلال فلز M و احیای اکسیژن به یونهای هیدروکسید است.
واکنش اکسیداسیون
–M →M2+ + 2e
واکنش احیا
–O2+ 2H2O+2e– → 4OH
بررسی واکنش اکسیداسیون
در ابتدا این واکنشها به صورت یکنواخت در سرتاسر سطح صورت میگیرد که شامل منطقه درون شیار هم میشود. همچنین، تعادل بار در فلز و محلول برقرار میشود.
هر الکترونی که حین تشکیل یونهای فلزی تولید میشود، سریعا توسط واکنش احیای اکسیژن مصرف میشود. همچنین، یک یون هیدروکسید به ازای هر یون در محلول تولید میشود. پس از یک زمان کوتاه، اکسیژن درون شیار به علت جا به جایی محدود محلول تمام شده و احیای اکسیژن در این ناحیه متوقف میشود.
این اتفاق به نوبه خود تغییری در رفتار خوردگی به وجود نمیآورد. از آنجایی که ناحیه بین یک شیار معمولا در مقایسه با سطح بیرونی، خیلی کوچک است، در نرخ کلی احیای اکسیژن تقریبا تغییری به وجود نخواهد آمد. بنابراین، نرخ خوردگی داخل و خارج شیار یکسان باقی میماند.
اتمام اکسیژن درون شیار یک اثر غیرمستقیم پراهمیت دارد. زمانی که اکسیژن تمام میشود، احیای اکسیژن در آن ناحیه صورت نمیگیرد. ولی خوردگی ادامه مییابد و ناحیه درون شیار دارای میزان زیادی بار مثبت میشود.
این بار مثبت ایجاد شده یونهای کلرید را به سمت خود کشیده تا تعادل بار برقرار شود. این مسئله باعث تشکیل میزان قابل توجهی کلریدهای فلزی درون شیار میشود.
هیدرولیز نمک فلزی
به استثنای فلزات قلیایی، کلریدها و سولفاتهای فلزی در آب هیدرولیز شده و تشکیل HCl و هیدروکسید فلزی میدهند. مکانیزم مذکور در شکل زیر به نمایش گذارده شده است.
هیدرولیز نمک فلزی
M+Cl– +H2O → MOH +HCl
اسید تشکیل شده در شیار باعث ادامه یافتن فرآیند خوردگی شده و واکنش انحلال فلز درون شیار ادامه مییابد.
تصویر زیر، “خوردگی زیر رسوبی”، ناشی از رسوب محصولات خوردگی و تشکیل پوستههای معدنی را نشان میدهد. این مورد بر روی سطوح داخلی لولههای خطوط آتش نشانی ایجاد شده است.

خوردگی حفره ای (pitting corrosion)
نوع دیگری از خوردگی، خوردگی موضعی شدید است که باعث ایجاد سوراخ در فلز میشود. قطر سوراخها میتواند بزرگ یا کوچک باشد، اما در بیشتر موارد نسبتا کوچک هستند.
حفرهها گاهی به صورت مجزا هستند، یا خیلی نزدیک به یکدیگر و میتوانند شبیه یک سطح ناهموار شوند. یک حفره میتواند به عنوان یک فضای خالی یا سوراخ تعریف شود که قطر سطحی آن برابر یا بیشتر از عمقش باشد.
شکل زیر حفره دار شدن پروانهی یک پره کمپرسور است و آثار این خوردگی را مشخص می کند.

خوردگی بین دانه ای (Intergranular corrosion)
توسط ناخالصیها در مرزدانه ها، غنی شدن از یک عنصر یا خالی شدن از آن پدید میآید. درصد کمی از آهن در آلومینیوم، جایی که انحلال آهن کم است، میتواند در مرزدانهها جدایش بوجود آورد. این باعث خوردگی بین دانهای میشود.
گونه دیگری از این خوردگی هنگام تخلیه مرزدانههای فولاد زنگ نزن از کروم دیده میشود. شکل زیر حساس شدن مرزدانههای فولاد زنگ نزن را به علت تشکیل کاربید کروم در مرزدانههای فولاد نشان میدهد.

جدایش انتخابی (Selective leaching) در خوردگی چیست؟
جدا شدن فلز از آلیاژ جامد، توسط پروسه خوردگی است. اگر بخواهیم درباره این نوع خوردگی بدانیم، میتوانیم به معروفترین نوع آن که جدایش روی از برنج (زدایش روی) است اشاره کنیم.
پروسه مشابهی در سیستمهای آلیاژی دیگر اتفاق میافتند که درآنها آلومینیوم، آهن، کبالت و کروم جدا میشوند.
خوردگی سایشی (Erosion corrosion)
شدت گرفتن و افزایش نرخ تخریب روی سطح فلز به علت حرکت نسبی یک سیال خورنده و سطح فلز است. عموما این حرکت کاملا کند است و همراه با سایش مکانیکی و خراش است.
فلز به صورت یون آهن حل شده از سطح جدا میشود، یا محصولات جامد خوردگی را تشکیل میدهد و به صورت مکانیکی از روی سطح روبش میشوند.

ترک خودگی ناشی از محیط (Environmentally Induced Cracking)
ترک خوردگی ناشی از محیط، نوعی از خوردگی است که عامل خارجی موثر بر آن تنش است.
دو نوع پدیده ترک خوردگی یا شکستگی مورد بحث قرار میگیرد:
- ترک خوردگی ناشی از خوردگی (SCC)
- خوردگی هیدروژنی(اغلب به عنوان شکست هیدروژنی نامیده میشود).
این دو پدیده شباهت های زیادی به یکدیگر دارند. به عنوان مثال، هر دو پدیده به طور کلی به تنش تسلیم و تنش اعمال شده بستگی دارد.
با افزایش هر دوی این عوامل، مقاومت در برابر SCC، خوردگی هیدروژنی، تردی فلز مذاب و ترید فلزات جامد کاهش مییابد.
نظریهها در ارتباط با مکانیزمها:
لازم به ذکر است که هیچ نظریه رضایت بخشی برای هیچ یک از این مکانیزمها وجود ندارد. نظریهای که به طور کامل تمام رفتارهای مشاهده شده در شرایط آزمایشگاهی یا میدانی را توضیح دهد.
بسیاری از نظریهها مربوط به رفتار برخی از سیستمها یا محیطهای آلیاژی است. اما هیچ یک به اندازه کافی جامع نیستند. به عنوان مثال، نمیتواند توسعه رفتارهای مختلفی که خوردگی هیدروژنی را برای سیستمهایی که هیدریدها را در مقابل آلیاژهای آهن که هیدرید تشکیل نمیدهند، توضیح دهد.
بسیاری از این عوامل متناقض وجود دارد که مانع توسعه نظریهای فراگیر میشود. علاوه بر این، از دهه 1960 در مورد علل واقعی میکرومکانیستی SCC، اختلاف نظر وجوددارد. اختلاف نظر در این است که برخی از محققان آن را مربوط به تخریب هیدروژنی میدانند و نه یک مسیر فعال خوردگی.
دادههای قانع کننده خاصی برای نقش هیدروژن در SCC برخی از آلیاژها وجود دارد. اما دادههای کافی برای شرح این مفهوم در دسترس نیست.
مدلهای مکانیکی رضایت بخشی برای هیچ یک از اشکال خوردگی تنشی محیطی ایجاد نشده است. زیرا پیش بینی خوردگی تنشی با محیط اساساً وجود ندارد.
با این حال، نیاز به پیش بینی این نوع تخریبها بسیار مهم است. زیرا خوردگی قابل مشاهده و اندازه گیری معمولاً قبل یا در حین شروع یا انتشار ترک رخ نمیدهد.
هنگامی که خوردگی رخ میدهد، بسیار موضعی است. مانند خوردگی حفرهای یا شکافی که تشخیص آن ممکن است دشوار باشد.
ترک خوردگی تنشی (Stress corrosion cracking)

نوع دیگری از خوردگی است که در پی اثر همزمان تنش کششی و محیط خورنده رخ میدهد. بسیاری از محققین تمام تخریبهای ناشی از ترک را که در محیطهای خورنده رخ میدهد، SCC مینامند مثل تخریب به سبب تردی هیدروژنی.
به عنوان مثال، حفاظت کاتدی روش خوبی برای جلوگیری از SCC است ولی باعث تردی هیدروژنی میشود.
تخریب هیدروژنی (Hydrogen damage)
که به عنوان تخریب مکانیکی فلز در اثر حضور و تقابل با هیدروژن است.
تخریب هیدروژنی به چهار دسته بزرگ تقسیم بندی میشود:
- تاول هیدروژنی (Hydrogen blistering)
- تردی هیدروژنی (Hydrogen embrittlement)
- زدایش کربن (Decarburization)
- حمله هیدروژنی (Hydrogen attack)
1. تاول هیدروژنی (Hydrogen blistering)
تاول زدن هیدروژنی از نفوذ هیدروژن در فلز منتج میشود. یک نمونه از تاول زدن در شکل زیر نشان داده شده است. نتیجه تغییرشکل موضعی و نهایتا تخریب کامل قطعه است.

2. تردی هیدروژنی (Hydrogen embrittlement)
تردی هیدروژنی نیز به واسطه نفوذ هیدروژن در فلزکه منجر به از دست رفتن داکتیلیتی (انعطاف پذیری) و استحکام کششی میشود، ایجاد میشود.
3. زدایش کربن (Decarburization)
دکربوره شدن یا از دست رفتن کربن فولاد توسط هیدروژن مرطوب در دماهای بالا ایجاد میشود. دکربوره شدن تنش کششی فولاد را کاهش میدهد.
4. حمله هیدروژنی (Hydrogen attack)
حمله هیدروژنی به تقابل بین هیدروژن و جزیی از آلیاژ در دمای بالا اطلاق میشود.
خوردگی میکروبی چیست؟
خوردگی میکروبی (Microbiologically influenced corrosion (MIC)) نوعی از خوردگی است که به واسطه فعالیت و حضور میکروبها،باکتریها، میکروجلبکها، مواد معدنی و آلی و شیمیایی ایجاد میشود.
این نوع خوردگی انواع مختلفی دارد و قابل کنترل کردن با روشهای سنتی و آفت کشها است.
MIC تقریبا روی تمام سطوح فلزی که در معرض سیستمهای غیر استریل هستند رخ میدهد، که در واقع به انحلال فلز و از دست رفتن خواص مکانیکی میانجامد.
این نوع ازخوردگی در نیروگاهها و صنایع شیمیایی، همچنین مکانهایی که از برجهای آب خنک استفاده میکنند، مشاهده میشود.

باکتریهای مختلفی باعث خوردگی میکروبی میشوند مثل باکتری احیا کننده سولفات (sulfate-reducing bacteria (SRB))، باکتری احیا کننده نیترات(nitrate-reducing bacteria)، باکتری متانوژنیک (مولدگاز متان(methanogenic bacteria))،
باکتری تولید کننده اسید (acid-producing bacteria)، باکتری اکسید کننده آهن (iron-oxidizing bacteria (IOB))، باکتری اکسید کننده گوکرد (sulfur-oxidizing bacteria).
در ادامه به تقسیم بندی میکروبها در مبحث خوردگی با توجه به نیاز اکسیژن، میپردازیم.
میکروبهای هوازی
میکروبهایی که در فرایند سوخت و سازخود نیاز به اکسیژن دارند هوازی نامیده میشوند. این میکروبها درمحیطهای مغذی حاوی اکسیژن حل شده رشد میکنند.
میکروبهای غیر هوازی
میکروبهایی هستند که بهترین شرایط برای رشد آنها در محیطهای با اکسیژن کم یا بدون اکسیژن است. خوردگی میکروبی در محیطهای آبی و خاکی دیده میشود ومسئول بیش از %30 از آسیبهای خوردگی است.
حدود80-90% باکتریهای شناخته شده به اکسیژن نیاز دارند؛ به همین دلیل در محیطهای صنعتی اکسیژن را از سیستم حذف میکنند، اما همچنان باکتریهای غیرهوازی مخربی وجود دارند و باعث خوردگی میشوند.
از مهمترین میکروبهای غیرهوازی Sulfate-reducing bacteria (SRB) است.
SRB ها به صورت دسته جمعی زندگی میکنند و محصولات ژلاتینی و لجنگونهایی ایجاد میکنندو فعالیت این میکروبها اکسیژن و pH را کاهش میدهد که باعث تشدید خوردگی میشود.
به سبب فراوانی یون (−SO42) در محیطهای آبی، SRB به عنوان مجرم اصلی خوردگی میکروبی بیهوازی شناخته میشود. SRB یون (−SO42) را به عنوان یک واسط الکترون برای تولید انرژی در متابولیسمشان مصرف میکنند. مصرف این یونها به صورت غیر مستقیم باعث تجمع سولفید خورنده و تولید محصولات معدنی اسیدی میشود که باعث حفره دار شدن فلزات میشوند.
تئوری های مطرح شده برای SRB در خوردگی چیست؟
مکانیزمهای گوناگونی برای MIC توسط SRB پیشنهاد شده است. این مکانیزمها شامل مکانیزم دپلاریزاسیون، سل خورنده موضعی و خوردگی القا شده توسط متابولیت است.
تئوری دپلاریزاسیون کاتدی به صورت گسترده در مقالات چاپ شده است که به نقش باکتری در MIC که شامل انتقال الکترون از ناحیه کاتدی به پروسه احیای –SO42 از طریق حضور هیدروژن واسط (مانند hydrogenase) است اشاره میکند.
سولفید فلزی با فعالیت SRB، به واسطه برقراری یک زوج گالوانیک فلز/سولفید، خوردگی موضعی را باعث میشود. حتی در عدم حضور H2S، که باعث ایجاد شدن خوردگی گالوانیک میشود.
اخیرا تئوری انتقال الکترون فراسلولی (extracellular electron transfer (EET)) مفهوم جدیدی از تقابل فلز / میکروب ارایه میدهد. طبق این تئوری احتمال دارد که الکترونها با رد شدن از دیواره سلول از خارج از سلول به سیتوپلاسم وارد شده باشند. این امر منجر به خوردگی شدیدتر میشود.
باکتری اکسید کننده آهن (iron-oxidizing bacteria (IOB)) در خوردگی چیست؟
IOB یا آنچه که به عنوان میکروارگانیسم رسوب دهنده فلز شناخته میشود، به عنوان عوامل MIC درنظر گرفته میشود. در یک محیط هوازی، IOB میتواند باعث رسوب هیدروکسید آهن (Fe(OH)3, FeOOH, Fe2O3) در فراسلولها شود. همچنین میتواند باعث به وجود آمدن انواع خوردگی شود.
این میکروارگانیسمها انرژی رشد خود را از اکسیداسیون یونهای فروس (+Fe2) به فریک (+Fe3) و اکسیژن به عنوان انتقال دهنده الکترون که در انتها به عنوان هیدروکسید فریک رسوب میکند، تولید میکنند.

مکانیزم خوردگی میکروبی
مکانیزم دپلاریزاسیون کاتدی به عنوان شناخته شدهترین مکانیزم خوردگی SRB در مجلات متعدد بازنشر شده است. اولین بار درسال 1934 توسط کوهر و ولات پیشنهاد شد.
زمانی که فلزات در معرض آب قرار میگیرند، با از دست دادن یونهای مثبت فلزی پلاریزه میشود. الکترونهای آزاد پروتونهای آب را در غیاب اکسیژن (شرایط بی هوازی) احیا میکنند (واکنش کاتدی) تا هیدروژن بوجود آید که روی سطح فلز ساکن میشود.
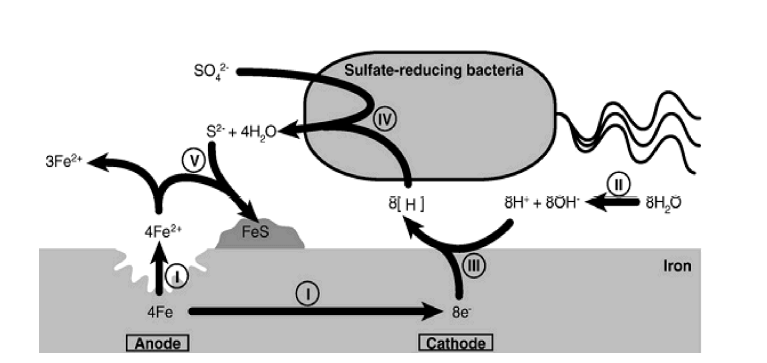
انتظار میرود که SRB هیدروژن را مطابق واکنش 4 جدول زیر مصرف کنند که میتواند منجر به اکسیداسیون آهن شود. این پروسه انحلال آندی و متعاقبا تشکیل FeS و Fe(OH)2 به عنوان محصولات خوردگی را سرعت میبخشد.
طبق این تئوری مهار پیوسته فیلم هیدروژن به وسیله SRB باعث انحلال آهن میشود. بنابراین این نظریه حاکی از آن است که هر باکتری بیهوازی مصرف کننده هیدروژن، میتواند باعث خوردگی آهن شود.

برخی از عوامل مهم در خوردگی باید وجود داشته باشد مانند:
- منبع انرژی
- مواد مغذی، به ویژه منبع کربن
- نیتروژن
- هیدروژن
- اکسیژن
- فسفات
- گوگرد
- اهداءکنندگان و گیرندههای الکترون که مکانیزم متابولیکی خوردگی توسط میکروب ها انجام شود.
زگیلی شدن (Tuberculation) در خوردگی چیست؟
در اینجا بررسی می کنیم که اصطلاح زگیلی شدن در خوردگی چیست و به چه معنا است. زگیلی شدن سطح فولاد که به تیوبرکولیشن نیز معروف است همراه با تشکیل برآمدگیهایی قرمز-قهوهای اکسید آهن در قسمت داخلی لولههاست.
تیوبرکولیشن بیشتر در فولاد هایی دیده میشود که قبل از سال 1940 ساخته شدهاند و معمولا جزء مهمی از سیستم توزیع آب به حساب میآیند. از آنجا که این نوع خوردگی در پی گذر زمان بوجود میآید، مصرف کنندگان در انتهای قرن 21 متوجه اثرات آن خواهند شد.
این پدیده در دسته خوردگی باکتریایی قرار میگیرد و کاملا با لولههای قدیمی مرتبط است. تیوبرکولیشن با فعالیت میکروارگانیسم ها در محیط لوله مرتبط است. باکتریها در لوله از آهن و منگنز آب تغذیه میکنند که نهایتا منجر به تشکیل رسوب و تجمع محصولات آهن/ منگنز روی سطح داخلی لوله میشود.

خوردگی متالورژیکی(Metallurgically Induced Corrosion)
برای درک بهتر پدیده خوردگی متالورژی، ابتدا باید بدانیم منظور از متالورژی چیست.
منظور از متالورژیکی:
علم متالورژی، شامل موارد زیر میشود:
- بازیابی فلزات از سنگ معدن (متالورژی استخراجی)
- تشکیل فلزات به اشکال مختلف (متالورژی مکانیکی) و درک تعامل گونههای شیمیایی
- جهت گیری بلورها و جابهجا شدن در فلزات و آلیاژها (متالورژی فیزیکی)
همه این فرایندها میتوانند ترکیب، ساختار، سطح تنش و ناخالصیهای فلزات و آلیاژها و در نتیجه رفتار خوردگی آنها را تحت تأثیر قرار دهند. فرایند دیگر، جوشکاری، معمولاً پس از تشکیل و شکلگیری فلزات با تکنیکهای متالورژی مورد استفاده قرار میگیرد.
درک اساسی از سینتیک خوردگی الکتروشیمیایی:
درک اساسی از سینتیک خوردگی الکتروشیمیایی بر اساس انحلال یکنواخت فلز خالص و همگن است که به طور مساوی در همه مکانها در معرض یک محیط همگن قرار دارد. مهندسان خوردگی میدانند که این توصیف واقعیت را در شرایط عملی منعکس نمیکند.
در بسیاری از سازههای مهندسی، آلیاژهای متفاوت به طرق مختلف به هم متصل میشوند. اغلب شکافهایی وجود دارد و محیط متغیر است و به شرایط سیال وابسته است.
علاوه بر این، فلزات و آلیاژها معمولاً با یک لایه سطحی پوشانیده شدهاند. رفتار خوردگی آنها تحت تأثیر لایه سطحی و تعدادی از عوامل متالورژی است.
حتی تک کریستالهای خالص نیز دارای نقصهایی هستند که میتوانند بر خوردگی تأثیر بگذارند. ناخالصیها و عناصر آلیاژی، مرزدانهها، فازهای دوم و اجزاء آن اغلب اثر گذارند.
سرانجام، سازههای جوشکاری شده زودتر دچار خوردگی میشوند. به دلیل آن که ناهمگنی متالورژیکی در جوشها و در مجاورت آنها وجود دارد.
مستعدترین محل یا نقص روی سطح:
به طور کلی، مستعدترین محل یا نقص روی سطح فلز اولین موردی است که در معرض محیط خورنده قرار میگیرد. بسته به عناصر آلیاژی، مقاومت خوردگی فولادهای ضد زنگ و آلیاژهای پایه نیکل به طور قابل توجهی متفاوت است.
در بسیاری از شرایط، فولادهای ضد زنگ دچار خوردگی موضعی میشوند که به شدت تحت تأثیر ترکیب آلیاژ و عوامل متالورژی قرار دارد.
خوردگی حفرهای در فولادهای ضد زنگ، اغلب از آخال سولفید منگنز (MnS) آغاز میشود. علت را میتوان در واکنش محصولات حاوی سولفید (S) و اثر انحلال این محصولات روی فیلم پاسیو دانست.
تشکیل کاربیدها در مرز دانه میتواند مقاومت در برابر خوردگی را از طریق تشکیل مناطق حساس به تخلیه کروم (Cr) در زمینه مجاور کاهش دهد.
یک شبکه پیوسته از چنین مناطق تخلیه شده از Cr میتواند فولاد ضد زنگ را حساس کرده. همچنین میتواند نسبت به خوردگی بین دانهای یا خوردگی تنشی مستعد کند.
خوردگی چیست ؛ خوردگی اتمسفری
خوردگی اتمسفری، فرسایش و تخریب مواد فلزی و خواص آنها، در اثر تعامل با جو زمین در دمای مشخص هوا، رطوبت، شیمی هوا و مقادیر آب و هوایی است. این نوع خوردگی از خوردگی فلزات که در دمای بالا و نبود رطوبت روی سطح فلز (خوردگی خشک یا گازی) رخ میدهد و با رطوبت و دمای اتمسفری زمین مطابقت ندارد، متمایز است.
مکانیزم خوردگی در دمای بالا به صورت شیمیایی است و کاملاً با خوردگی اتمسفری متفاوت است.
اکثر سازهها و تجهیزات فلزی تا حدودی در معرض شرایط اتمسفری قرار دارند و امکان ایجاد خوردگی اتمسفری در آنها وجود دارد. در برخی موارد که خوردگی شدید است، فلز میتواند به طور کامل از بین رفته و به محصولات خوردگی تبدیل شود.
با پیش زمینه و دانش کافی از شرایط اصلی تماس فلز و اتمسفر و تأثیر آن بر خوردگی فلز، میتوان از بسیاری از مشکلات جدی خوردگی جلوگیری کرد.

علت ایجاد خوردگی اتمسفری
چندین صنعت به دلیل اتمسفرهای بسیار تهاجمی با مشکلات خوردگی زیادی روبرو هستند. از جمله صنایع انتقال و توزیع نیروی برق، کارخانهها و تجهیزات تولید مواد شیمیایی/ پتروشیمی، هواپیما، تولید خودرو و اجزای مرتبط، زیرساختهای حمل و نقل، سازهها و تجهیزات دریایی، صنعت ساختمان و دستگاههای الکترونیکی.
این نوع خوردگی به طور خود به خود رخ میدهد. امکان پیشگیری وکنترل آن وجود دارد اما هرگز متوقف نمیشود. دلیل آن این است که فلزاتی که معمولا استفاده میشوند به جز برخی فلزات نجیب به صورت خالص روی زمین نیستند. فلزات معمولاً در کانیها و سنگ معدن، ترکیبات شیمیایی شامل اکسیژن، هیدروژن و گوگرد هستند.
این ترکیبات معدنی، حالت پایدار ترمودینامیکی فلزات هستند که در آنها انرژی آزاد گیبس دارای حداقل مقدار است. برای جداسازی فلزات از سنگ معدن آنها و برای فرآیندهای متالورژی و تولید، انرژی به صورت گرما، شیمیایی، الکتریکی یا مکانیکی، فلز را به سطح انرژی بالاتری میرساند.
مکانیزم خوردگی اتمسفری
محصول فلزی از نظر ترمودینامیکی پایدارترین حالت خود را ندارد. این واقعیت باعث میشود فلزات به محصولات خوردگی تبدیل شوند که دارای ترکیب شیمیایی مشابه سنگ معدن اصلی هستند و از نظر ترمودینامیکی پایدارتر اند.
هنگام تماس فلزات با اتمسفر (اکسیژن) و آب (رطوبت) در حضور گونههای خورنده مانند کلریدها یا دی اکسید گوگرد، فرآیند خوردگی آغاز میشود و محصولات خوردگی مانند اکسیدها، هیدروکسیدها یا اکسی هیدروکسیدها تشکیل میشوند.
عامل اصلی فرایند خوردگی اتمسفری یک فرآیند آبی بوده و مکانیزم آن الکتروشیمیایی است. در طول واکنش شیمیایی نه تنها انتقال جرم بلکه تبادل ذرات باردار (الکترون و یون) در سطح مشترک فلز (رسانای الکترونیکی) و الکترولیت (رسانای یونی) انجام میشود.
نقش آند و کاتد در این نوع خوردگی چیست ؟
انتقال الکترونها (جریان سیال الکتریکی) به دلیل تشکیل یک سل خوردگی گالوانیکی روی سطح فلز رخ میدهد. سه عنصر برای عملکرد سل خوردگی ضروری است: آند و کاتد، الکترولیت و عامل اکسید کننده. محلهای آند و کاتد سلهای خوردگی متعددی را تشکیل میدهند.
آندها نواحی روی فلز هستند که به دلیل عوامل مختلف مانند ترکیب فلز ناهمگن، مرزدانه، چندین فاز متالورژیکی، نقصهای فلزی محلی و عملیات فلزی غیر یکنواخت (مثل عملیات حرارتی نادرست) حالت انرژی بالاتری دارند.
واکنش خوردگی اکسیداسیون در محلهای آندی انجام میشود:
![]()
این فلز در آند حل شده و کاتیون (یونهای دارای بار مثبت) ایجاد میکند. آنها ممکن است در اصل به عنوان یونهای هیدراته فلز ![]() ظاهر شوند اما در نهایت به اکسیدها و هیدروکسیدها و محصولات خوردگی فلز تبدیل میشوند. مثلا محصولات خوردگی اتمسفری که از جنس فولاد هستند معمولاً شامل g-FeOOH به عنوان اجزای اصلی هستند.
ظاهر شوند اما در نهایت به اکسیدها و هیدروکسیدها و محصولات خوردگی فلز تبدیل میشوند. مثلا محصولات خوردگی اتمسفری که از جنس فولاد هستند معمولاً شامل g-FeOOH به عنوان اجزای اصلی هستند.
خوردگی اتمسفری؛ واکنش آندی و کاتدی در این نوع خوردگی چیست ؟
کاتدها مکانهای فلزی با حالت انرژی پایینتر هستند. مثلا، اجزای غیر فلزی بیاثر و فازها یا ساختارهای فلزی فعال کمتر فعال. واکنش کاتدی در این مکانها اتفاق میافتد و شامل کاهش عامل اکسیدکننده مانند هوا، اکسیژن یا یونهای هیدروژن است.
الکترولیت مانند رطوبت با سطح فلز در تماس است. رطوبت شامل گونههای یونی محلول (آلایندههای اتمسفری) و همچنین رسانای یونی خوبی است که میتواند واکنشهای الکتروشیمیایی را حفظ کند.
یک عامل اکسیدکننده مانند اکسیژن و یونهای هیدروژن (+H) برای پذیرش الکترونهای ساطع شده از فلز در واکنش آندی ضروری است:

جایی که Oxy عامل اکسید کننده و Red گونه کاهش یافته است.

در وب سایت رسمی شرکت نفتان پایش، در بخش مجله تخصصی خوردگی مطالب بیشتری، با موضوع خوردگی چیست خواهید یافت.
با ما همراه باشید.
منابع:
- Mars G. Fontana, Corrosion engineering, Third edition, McGrow-hill book company, 1910.
- bloggingwithjimmyd.wordpress.com
- https://www.ejot.com/heavy-duty-anchor-guide/effects-of-corrosion
- https://fractory.com/aluminium-corrosion/
- https://www.nace.org/resources/general-resources/corrosion-basics/group-3/stress-corrosion-cracking
- https://www.vectorstock.com/royalty-free-vector/dry-cell-battery-vector-10501510
- https://corrosion-doctors.org/Corrosion-Forms/area-effects.htm













ممنون از مطالب بسیار مفید و کاربردی✔️
مقاله خوردگی چیست، یکی از کامل ترین مطالب در زمینه خوردگی بود.
متشکر از زحمات کلینیک تخصص خوردگی نفتان پایش
خورسندیم مقاله خوردگی چیست که توسط کلینیک تخصصی خوردگی نفتان پایش منتشر شده، مورد توجه شما کاربر گرامی قرار گرفته است.
درود بر شما
فوق العاده بود ممنون