خوردگی فلزات و عوامل تشدید آن
خوردگی فلزات؛ سرعت فعل و انفعال خوردگی به عوامل سینتیکی و ترمودینامیکی متعددی ربط دارد مانند دما، pH سرعت سیال و غلظت محیط اثرکننده بستگی خواهد داشت.
مهمترین عواملی که در واکنشهای خوردگی دخالت مؤثر دارند، عبارت است از:
تأثیر درجه حرارت در خوردگی فلزات
افزایش دما موجـب افـزایش میـزان و سرعت خـوردگی میشـود. حتی زمانیکه دمای قسمتهای مختلف از قطعهی معینی، متفاوت باشد. عموماً آن قسمت که دمـایش بالاتر است، نسبت به سایر نقاط آندتر میگردد.
دما نسبت به خوردگی اکسیژن نقشی دوگانه بازی میکند، افزایش دما حل پذیری اکسیژن را کاهش میدهد.
مطلب مرتبط: خوردگی چیست؟
تاثیر اختلاف پتانسیل در خوردگی فلزات
به علت اختلاف پتانسیل موجود بین الکترودها (مثلاً ۲ فلز روی و آهن در آب نمک)، فلـزی که فعال تر است، آند است و خورده میشود. این در حالتی که فلزات غیر همجنس و متصل به هم در محیط الکترولیت مشترکی قرار گرفته باشند. در این واکنش، عمل خوردگی فلزات صورت نمیگیرد و فلز دیگر حفاظت خواهد شد.
عملیات حرارتی
اجرای عملیات حرارتی، اغلب رفتار خوردگی فلزات و آلیاژها را شدیدا متأثر میسازد.
شرایط سطحی
تأثیر “شرایط سطحی” در خوردگی فلزات.
به وجود آمدن شرایط سطحی، از دیگر عوامل خوردگی فلزات است. شروع واکنش و سرعت خوردگی در مورد سطوح صیقلی و تمیز فلزات نسبت به سطوح زبر و خشن و یا سطوحی با فیلمهای سطحی و یا دیگر مواد خارجی، به شدت تغییر می کند.
سرعت
تأثیری که سرعت میتواند بر خوردگی فلزات داشته باشد…
اثرات تخریبی سایدگی مکانیکی به تنهایی مورد بحث نیست اما به دلایل زیر مورد توجه قرار میگیرد.
- فیلمهای اولیهی خوردگی (که در اغلب موارد مانع پیشرفت خوردگی است)، به دلیل ساییدگی از بین میرود.
- سطح فلز فعال مجددا در معرض خوردگیهای بعدی قرار میگیرد.

مطلب مرتبط: حفاظت کاتدی چیست؟
تشعشع
تاکنون در زمینه تأثیر تشعشع بر خوردگی فلزات بررسیها و تحقیقات نسبتا کمتری صورت گرفته. تشعشع از موضوعاتی است که باید مورد توجه بیشتری قرار گیرد.
البته دربارهی صدمات ناشی از محیطهای حاوی تشعشعات اتمی بر روی فلزات، آزمایشهایی صورت گرفته. این آزمایشها نشان داده است که در چنین شرایطی میزان و شدت خوردگی فلزات افزایش میباید.
ناخالصی محیطی
وجود ناخالصیهای مختلف در محیط، از مهمترین عوامل خوردگی فلزات است. این ناخالصیها اثرات گوناگونی بر روی نحوه و میزان خوردگی میگذارد.
زمان
اثرات و صدمات خوردگی فلزات معمولا نسبت به زمان افزایش مییابد. در برخی حالات بین آنها رابطهای خطی وجود دارد. البته در برخی شرایط ممکن است میزان خوردگی نسبت به زمان کاهش پیدا کند. که اغلب به ماهیت پرششها و رسوباتی بستگی دارد که در سطح فلزات به وجود میآید.
تنش
میزان تخریب مواد در قطعات و تجهیزات صنعتی در شرایط زیر شدیدتر میگردد:
- شرایطی که تحت تأثیر تنشهای کششی بوده و در معرض محیطهای خورنده نیز قرار میگردد.
- زمانی که تنشها در حدود (یا بیش از) حد ارتجاعی آنها باشد.
فشار
ما براساس بررسیها و مطالعات به این نتیجه رسیدیم که فشار ، عامل مؤثری در روی واکنشهای شیمیایی و اکسیداسیون مواد میباشد. از این رو لازم است به دقت مورد توجه قرار گیرد.
خواص فلزی
خواص فلزی میتوانند از تشدید کنند و از عوامل خوردگی فلزات باشند.
خواص و مشخصات متالورژیکی مواد نقش مهمی در میزان خوردگی آنها دارد. ساختمان بلوری، مرزدانهها، خواص مکانیکی اختصاصی فلزات و آلیاژها، روشهای ریختهگری، عملیات حرارتی و ترکیب شیمیایی آلیاژها از عوامل مهم و مؤثری است که باید مد نظر قرار گیرد.
سایر عواملی که میتواند در خوردگی فلزات تأثیر داشته باشد
وجود برخی عوامل و شرایط محیطی، باعث پیچیدگیهای زیاد در بررسیها و مطالعات خوردگی میشود. از جمله:
- اختلاف دمیدگی (هوا دهی) در سطوح تماس با الکترولیتها سبب ایجاد مناطق آندی و کاتدی میگردد.
- تفاوت غلظـت (یـا اخـتلاف در pH) در نقاط مختلـف سـطوح فلزی که در محیط الکترولیت یا خورنده قرار گرفته باشد، سبب ایجاد مناطق آندی و کاتدی میشود.
اثرات بیولوژیکی و وجود ماکروارگانیسمها یا میکروارگانیسمها، در روند خوردگی مـورد بررسی و آزمایش قرار گرفته و صدمات آنها آشکار شده است.
در برخی موارد با ایجاد لایـههـا با موانعی در سطوح فلزات، سبب تولید پیلهای اختلاف غلظتی میشود. و در مواردی دیگر با جذب هیدروژن از سطح فلز و لذا حذف آن به عنوان یک عامل مقاوم در پیلهای خوردگی منجر به انهدام فلزات میگردد.
از جمله «باکتریهای احیاء کنندهی سولفات» که تولید سولفورهای آهن در مناطق نزدیک به نقاط کاتدی نموده و منجر به تسریع یا خوردگی فلزات میشود.
مطلب مرتبط: خوردگی آهن و روشهای پیشگیری
اثر غلظت محیط خورنده
افزایش غلظت محیط خورنده منجر به افزایش سرعت در خوردگی فلزات اکتیو میگردد. اما تأثیر نامحسوسی بر سرعت خوردگی یک فلز با خاصیت پاسیو دارد.
در بعضی حالات با افزایش زیاد غلظت محیط، سرعت خوردگی فلزات با رفتار پاسیو افزایش مییابد. سرب دارای این خاصیت است و اعتقاد بر این است که سولفات سرب که در غلظتهای کم اسید سولفوریک پوسته محافظی است، در اسید غلیظ قابل حل خواهد بود.
عبارت اثرات محیطی مکانیزم هایی را شامل می شود که به فلزی خاص در محیطی خاص اختصاص دارند. این مکانیزمها اغلب مکانیزمهای ایجاد ترک هستند.
اثر غلظت اکسیژن و اکسیدکنندهها در خوردگی فلزات
یکی از عوامل مهم خوردگی در محیطهای آبی خورنده، میزان اکسیژن حل شده در محلول آبی است، به طوری که با افزایش اکسیژن و اکسیدها سرعت خوردگی نیز مرتبا بالا میرود.
اثر اکسیژن و pH نیز بر سرعت خوردگی فلزات بسیار تاثیر گذار است. وجود اختلاف دمش هوا (هوادهی) در سطوح مجاور با الکترولیتها سبب ایجاد مناطق آندی و کاتدی میگردد.
به عنوان مثال، در مورد محلولهایی که در تماس با اکسیژن هوا هستند، گاهی اوقات اکسیژن هوا به تمام سطح فلز به طور یکسان نمیرسد. این شرایط سبب میشود تا غلظت اکسیژن حل شده در یک منطقه از محلول افزایش و در منطقه ی دیگر کاهش یابد. در چنین محلولهایی پیل های اختلاف دمشی تشکیل شده و سبب ایجاد خوردگی خواهند شد.
خوردگی فلزات در محیط آب
آب به عنوان یک الکترولیت خوب همواره از دلایل اصلی زنگ زدگی و خوردگی فلزات است. خوردگی فلزات در آب به این دلیل است که آب با دی اکسید کربن موجود در هوا واکنش داده و اسید کربنیک تشکیل می دهد که یک اسید ضعیف است. اسید کربنیک نسبت به آب الکترولیت قویتری و زنگ زدگی فلزات را تسریع میکند.
خوردگی فلزات در آب دریا
آب دریا یکی از محیطهای خورنده برای فلزات است که صنایع دریایی، آب شیرین کنها بیشتر با آن مواجه هستند. برخلاف تصورات آب دریا فقط یک محلول از نمک های معدنی نیست بلکه حاوی مخلوطی از نمکها، گازهای حل شده، عناصر جامد معلق و عناصر آلی است که همگی می توانند فلزات را تحت تاثیر قرار دهند.
سرعت خوردگی فلزات در آب دریا نه تنها بستگی به نوع فلز و یا آلیاژ کاربردی دارد بلکه با عمق، درجه حرارت، میزان و نوع گازهای حل شده و ترکیبات آلی و معدنی و بسیاری از عوامل بیولوژیکی آب دریا تحت تاثیر قرار می گیرد.
مطلب مرتبط: مدیریت خوردگی
نمودارهای پوربه (Pourbaixs Diagrams)
مارسل پوربه (Marcel Pourbaix) ،یک روش مختصر و منحصربه فرد از خلاصـه کـردن اطلاعات ترمودینامیک خوردگی فلزات برای یک فلز مشخص در نمودار کارآمد پتانسیل -pH تدوین کرده است.
پوربه در این نمودارها نواحی معینی از پتانسیل و pH را که در آن، فلز دچار خـوردگی می شود و نواحی دیگری را که در آن از خوردگی محافظت می گردد را نشان می دهد.
چنین نمودارهایی را به طور معمول “نمودارهای پوربه” می نامیم اما گاهی وقتها نمودارهای تعادلی نیز نامیده میشوند. زیرا این نمودارها در شرایطی که در آن، فلز با محیطش در تعادل است، به کار میروند. نمـودارهـای پوربه برای بیش از ۷۰ فلز مختلف موجود است.
مثالی از یک نمودار پوربه در شکل زیر که نمودار پوربه برای آلومینیم را نشـان مـی دهـد، ارائه شده است. محور افقی در نمودار، pH محلول آبی است که معیـاری از محیط شیمیایی می باشد. محور عمودی، پتانسیل الکترود E است که معیاری از محیط الکتروشیمیایی می باشـد.
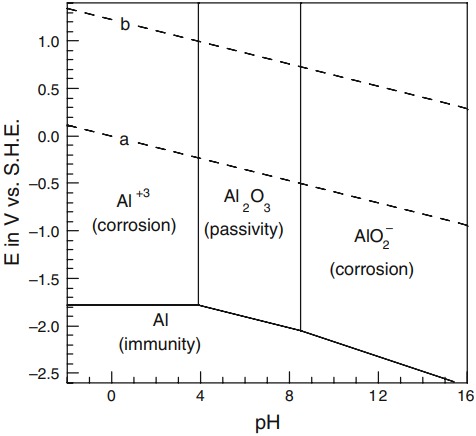
در یک نمودار پوربه، سه نوع خط راست ممکن است، وجود داشته باشد:
۱- افقی که برای واکنش هایی هستند که تنها شامل پتانسیل الکترود E می باشند (و نه pH).
۲- عمودی که برای واکنشهایی هستند که فقط pH را شامل میشوند (و نه پتانسیل الکترود E).
۳- مورب که متعلق به واکنشهایی هستند که هم شامل پتانسیل الکترود E و هم شامل pH می باشند.
همچنین نمودارهای پوربه، دارای نواحی یا قسمتهایی در بین خطوط مختلف هستند که گونه یا ترکیبهای شیمیایی خاص در آنها از لحاظ ترمودینامیکی پایدارند. نمودار پوربه آلومینیم در شکل زیر، نواحی مختلفی را که هر یک از گونههای Al (جامـد)، (جامـد). یـونهـای و یونهای در آنها پایدارند، نشان میدهد.
وقتی که گونه پایدار، یک یون حل شده باشد،به آن ناحیه در نمودار پوربه ناحیه “خوردگی” می گوییم. وقتی گونه پایدار یک اکسید یا هیدروکسید جامد باشد،به آن ناحیه در نمودار پوربه، ناحیه “رویین شـدن” می گوییم که در آن، فلز با یک فیلم سطحی اکسیدی یا هیدروکسیدی در برابر خوردگی فلزات حفاظت میگردد.
زمانی که گونه پایدار، خود فلز واکنش نداده باشد، آن ناحیه، ناحیـه ایـمـن است. کروگر، نمـودار پوربه را “نقشه امکان پذیری” توصیف کرده است.
نمودار پوربه آهن
نمودار پوربه آهن در شکل زیر نشان داده شده است. این نمودار به دلیل استفاده گسترده آهن و آلیاژهای آن در ساخت و ساز، مورد توجه ویژه است. آهن میتواند در محلولهـای اسیدی یا خنثی در دو حالت اکسیداسیون متفـاوت، یعنی +Fe2 و +Fe3، در معرض خوردگی قرار گیرد.

رویین شدن توسط فیلم های اکسیدی Fe2O4 و Fe2O3 تأمین میشود. خوردگی در محلولهای قلیایی، به شکل آنیونهای پیچیده ![]() رخ میدهد که مشابه یونهای حل شده
رخ میدهد که مشابه یونهای حل شده ![]() به ترتیب برای آلومینیم و فلز روی در محلول هـای قلیایی است.
به ترتیب برای آلومینیم و فلز روی در محلول هـای قلیایی است.
نمودار پوربه ساده شده آهن که در شکل نشان داده شده است، سه مفهوم متفاوت از حفاظت خوردگی را برای خارج کردن آهن از ناحیه خوردگی ارایـه می دهد.
برای نمونه، pH برابر با شش و پتانسیل الکترود ۴/۰- ولت نسبت به SHE، به ناحیه خـوردگی به شکل یونهای +Fe2 مربوط میشود. سه روش کنترل خوردگی به صورت زیر است:
۱- اگر پتانسیل الکترود در جهت منفی به مقداری کمتر از ۷/۰- ولت نسبت بـه SHE تغییـر کند، الکترود آهن به ناحیه ایمنی سوق داده میشود این فرآیند، حفاظـت کـاتـدی نامیـده میشود.
۲- اگر به جای آن، پتانسیل الکترود در جهت مثبت بـه مقـادیری بالاتر از حـدود ۰/۰ ولت نسبت به SHE تغییر کند، الکترود آهن به ناحیـه رویـیـن شـدن سـوق داده میشـود. ایـن فرآیند، حفاظت آندی نامیده میشود.
۳- سومین روش حفاظت، تغییر دادن pH محلول آبی است. اگر pH به حدود هشت یا بیشتر افزایش یابد، الکترود آهن، دوباره در ناحیه رویین شدن واقع خواهد شد.
محدودیتهای نمودار پوربه
۱- تعادل مفروض است (ولی در موارد عملی، شرایط واقعی ممکن است، دور از تعادل باشد)
۲- نمودار پوربه هیچ اطلاعاتی را در مورد نرخهای خوردگی واقعی نمیدهد.
۳- این نمودارها فقط به فلزهای تک عنصری اختصاص دارند و نه به آلیاژها (برای یک آلیاژ دوتایی محلول جامد، نمودارهای پوربه دو جزء، همچنان که در ادامه نشان داده خواهد شد میتوانند به عنوان یک تخمین ابتدایی، ادغام شوند. برای آلیاژهای مهندسی، نمودارهای پوربه تجربی، میتوانند گسترش یابند).
۴- رویین شدن، به همه اکسیدها و هیدروکسیدها بدون توجه به ویژگیهای حفاظتی واقعی آنها نسبت داده میشود (خوردگی ممکن است گاهی توسط نفوذ یونها از میان فیلمهای اکسیدی پیش رود، فرآیندی که در ساختار نمودارها نادیده گرفته میشود).
۵- نمودار پوربه، خوردگی موضعی به وسیله یـونهـای کلرید را در نظر نمیگیرد.
۶- به طور متداول نمودارهای پوربه ، به دمای ۲۵ درجه سانتی گراد اختصاص دارند (نمودارهای پوربه برای دماهای بالا وجود دارند).
کاربردهای نمودار پوربه
در حال حاضر، کاربردهای زیاد نمودارهای پوربه در خوردگی مورد توجه قرار گرفته است. کاربردهای گوناگون این نمودار عبارت است از :
۱- مقاومت فلزها به خوردگی یکنواخت در محلولهای آبی
۲- مبنای تعیین اینکه انتظار میرود، کدام فلزها بتوانند در یک محدوده گسترده از شرایط pH و پتانسیل رویین شوند.
۳- ارزیابی امکان استفاده از بازدارندههای اکسیدکننده
۴- شناسایی شرایط درونی یک پیل خوردگی موضعی
منبع
M. Pourbaix, “Atlas of Electrochemical Equilibria in Aqueous Solutions”, National Association of Corrosion Engineers, Houston, TX (1974)
Kruger in “Equilibrium Diagrams: Localized Corrosion”, R. P. Frankenthal Kruger, Eds., p. 45, The Electrochemical Society, Pennington, NJ (1984)












